Σύμφωνα με το σχολικό βιβλίο της Χημείας: «Όταν ο σχηματισμός ιοντικής ένωσης μεταξύ ατόμων είναι μάλλον αδύνατος, το καλύτερο που μπορεί να συμβεί σ’ αυτές τις περιπτώσεις είναι τα άτομα να διατηρήσουν ουσιαστικά τα ηλεκτρόνιά τους και να συνάψουν ταυτόχρονα μία συμφωνία «συνιδιοκτησίας» μεταξύ τους, να σχηματίσουν δηλαδή κοινά ζευγάρια ηλεκτρονίων. Όταν δύο γειτονικά άτομα κατέχουν από κοινού ένα ζευγάρι ηλεκτρονίων, λέμε ότι συνδέονται μέσω ενός ομοιοπολικού δεσμού. Το κοινό αυτό ζευγάρι ηλεκτρονίων δεν περιορίζεται σε ένα άτομο, αλλά απλώνεται σαν δίχτυ, περιβάλλοντας και τα δύο άτομα» .
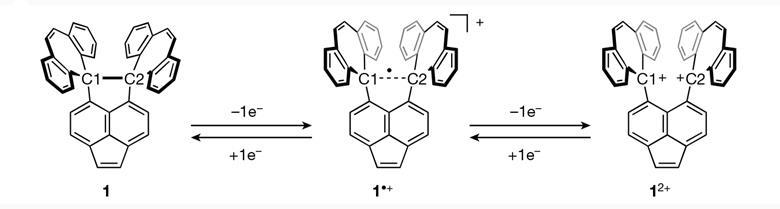
Οι ερευνητές από την Ιαπωνία Takuya Shimajiri, Soki Kawaguchi, Takanori Suzuki & Yusuke Ishigaki δημοσίευσαν μια εργασία με τίτλο «Direct evidence for a carbon–carbon one-electron σ-bond» , στην οποία περιγράφεται μια πρωτοποριακή ανακάλυψη που παραβιάζει τον σχολικό ορισμό του ομοιοπολικού δεσμού: εντόπισαν έναν ομοιοπολικό δεσμό μεταξύ δύο ατόμων άνθρακα που μοιράζονται μόνο ένα ηλεκτρόνιο.
Τέτοιου είδους δεσμοί είχαν προταθεί για πρώτη φορά το 1931 από τον Linus Pauling. Παρότι κάποιες πρωτοποριακές μελέτες έχουν αναφέρει ομοιοπολικούς δεσμούς με ένα ηλεκτρόνιο μεταξύ διαφορετικών ατόμων, καμία άμεση απόδειξη της ύπαρξής τέτοιων δεσμών μεταξύ ατόμων άνθρακα δεν είχε παρατηρηθεί μέχρι σήμερα.
Οι ερευνητές Shimajiri et al αναφέρουν την απομόνωση μιας ένωσης με έναν ομοιοπολικό δεσμό ενός ηλεκτρονίου μεταξύ δύο ατόμων άνθρακα C•C που επιβεβαιώθηκε πειραματικά και θεωρητικά. Τα αποτελέσματα της εργασίας αποδεικνύουν κατηγορηματικά την ύπαρξη ομοιοπολικού δεσμού με ένα μόνο ηλεκτρόνιο C•C, με μήκος 2,921 Å στους 100 K. Για να σταθεροποιηθεί αυτός ο εξωτικός δεσμός εγκλωβίστηκε σε δακτυλίους άνθρακα. Ενώ αρχικά ο δεσμός περιείχε δύο ηλεκτρόνια, όταν οι δακτύλιοι «τεντώνονταν», ο δεσμός επιμηκυνόταν, και σε συγκεκριμένη απόσταση έχανε το ένα ηλεκτρόνιο.
Αυτός ο νέος δεσμός αμφισβητεί την θεμελιώδη αντίληψή μας για το τι ακριβώς συνιστά έναν ομοιοπολικό δεσμό. Οι Ιάπωνες ερευνητές μεταξύ άλλων έχουν ως στόχο να διευκρινίσουν τι είναι ένας ομοιοπολικός δεσμός – συγκεκριμένα, από ποιά όρια και μετά ένας δεσμός χαρακτηρίζεται ως ομοιοπολικός; Στόχος τους είναι να αναζητήσουν ένα ευρύ φάσμα δεσμών που δεν έχουν ακόμη ανιχνευθεί, όχι μόνο μεταξύ ατόμων άνθρακα, αλλά μεταξύ όλων των στοιχείων.
διαβάστε περισσότερες λεπτομέρειες ΕΔΩ: https://www.chemistryworld.com/news/one-electron-covalent-bond-between-two-carbons-pushes-limits-of-bonding/4020283.article
Κατηγορίες:ΧΗΜΕΙΑ
Σχολιάστε